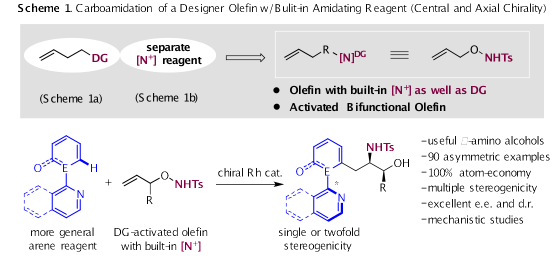
烯烃的双官能团化可以经济有效地合成含多个官能团的产物,为构建多样性的目标分子提供了丰富的合成方法。近日,前沿交叉科学青岛研究院分子科学与工程研究院李兴伟教授团队与合作者通过合理的底物设计,首次利用N-保护的O-烯丙基羟胺作为双官能烯烃,与三类(杂)芳烃进行不对称1,2-碳酰胺化得到手性氨基醇的反应。不对称碳酰胺化反应模式取决于(杂)芳烃试剂的性质。对于简单的非手性(杂)芳烃,反应得到具有优异对映选择性的中心手性β-氨基醇。而前轴手性或轴向外消旋杂芳烃的使用则可以合成具有优异对映和非对映选择性的轴+中心手性的氨基醇 (Scheme 1)。相关成果以“O-Allylhydroxyamine: a Bifunctional Olefin for Construction of Axially and Centrally Chiral Amino Alcohols via Asymmetric Carboamidation”为题,发表在国际知名期刊Journal of the American Chemical Society(中科院一区,TOP, IF=16.383)上。前沿交叉科学青岛研究院博士后米瑞杰为第一作者,李兴伟教授为通讯作者,山东大学为第一完成单位。
作者以N-嘧啶3-甲基吲哚与N-(烯丙氧基)-4-甲基苯磺酰胺2-Ts作为底物在手性铑催化剂催化下对反应条件进行了优化。通过对溶剂,添加剂及温度的筛选,最终在40℃下THF作为溶剂,叔戊酸作为添加剂,以手性三价铑(R)-Rh4作为催化剂能以91%的产率及98%的ee得到目标产物(R)-16。
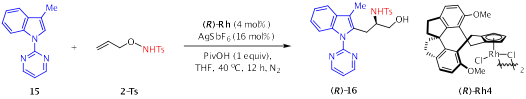
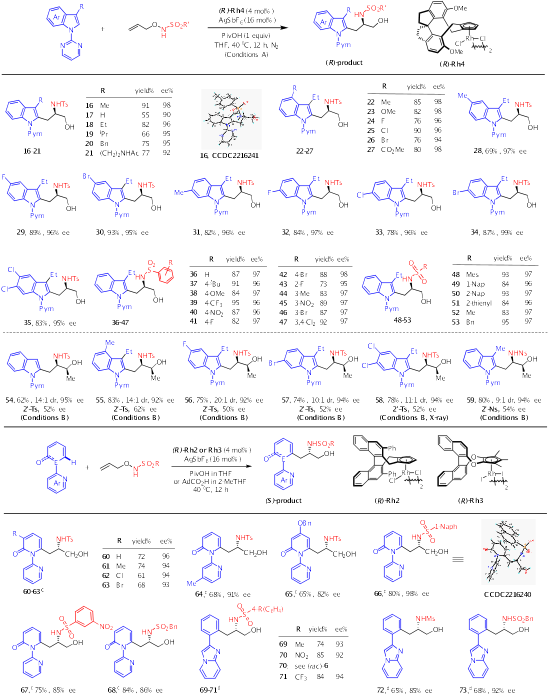
接着作者探究了不对称合成中心手性氨基醇的底物适用范围(Scheme 2)。在吲哚环的各个位置引入Me、OMe、酯和卤素基团都可以分离出具有优异对映选择性的产物。通过对烯烃底物范围的考察发现N-芳基磺酰基苯环不同位置的多种给电子、吸电子和卤素基团是完全兼容的,以良好的产率和优异的对映选择性得到目标产物。此外,该反应也成功地扩展到几种N-烷磺酰基取代的O-烯丙基羟胺。值得注意的是,烯丙位带有甲基的外消旋烯烃也适用于此反应(54-59)。在这类反应中,外消旋烯烃是通过动力学拆分(KR)参与反应的,生成含有两个相邻手性中心的氨基醇(10:1-20:1的dr和92–95%的ee)。
Scheme 2. Central ChiralityviaAsymmetric Carboamidation Using Five- and Six-Membered Arenes.
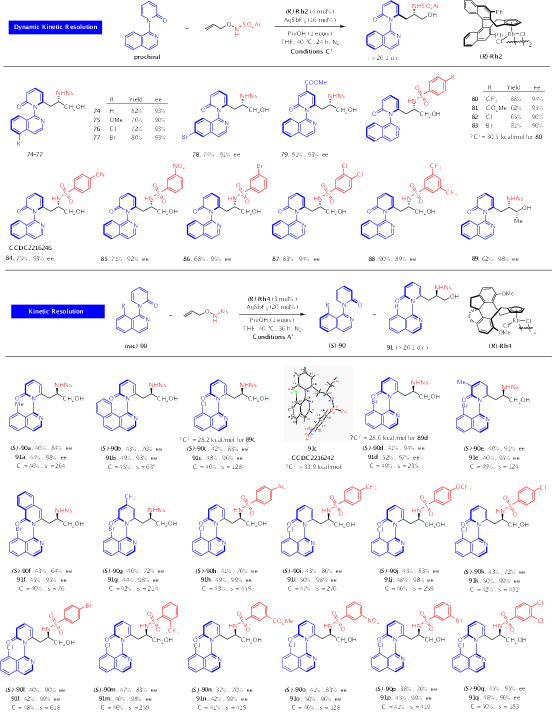
除了以高对映选择性合成中心手性氨基醇之外,作者也采用动态动力学转化和动力学拆分的策略,实现了轴加中心的手性氨基醇的高对映选择性及高非对映选择性合成(Scheme 3)。以N-异喹啉2-吡啶酮作为芳烃时,反应生成具有C−N手性轴外加中心手性的氨基醇。该反应利用(R)-Rh2作为最佳手性,异喹啉环不同位置吸电子或给电子基团的存在对反应活性及对映选择性的影响很小。对于带有更大位阻的8-取代的异喹啉定位基团的2-吡啶酮,由于芳烃本身具有轴手性,因此以动力学拆分模式与烯烃实现偶联。研究发现,不同取代的芳烃底物与各种烯烃的偶联都得到了良好的结果。回收芳烃的对映纯度普遍很高(64-95% ee),同时产物的对映选择性也很优异(93-99% ee),对应于63−618的s值。在上述所有反应中,产物的非对映选择性均为优秀(>20:1 dr)。
Scheme 3. Scope of Synthesis of Axially and Centrally Chiral Amino Alcohols.
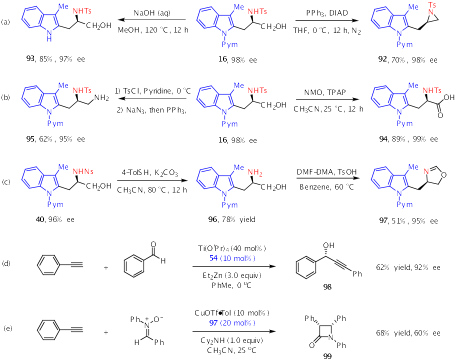
手性氨基醇54可以用作Ti催化的苯甲醛和炔基锌之间的亲核加成反应的配体,得到92% ee的手性醇产物。此外,产物40经过简单转化即可以良好的产率得到手性恶唑啉97。作者还将97作为手性配体应用于铜催化的苯乙炔和硝酮的不对称Kinugasa反应,生成手性四元环产物,证明了手性氨基醇和恶唑啉作为手性配体在不对称催化中具有应用潜力(Scheme 4)。
Scheme 4. Synthetic Applications of Representative Products.
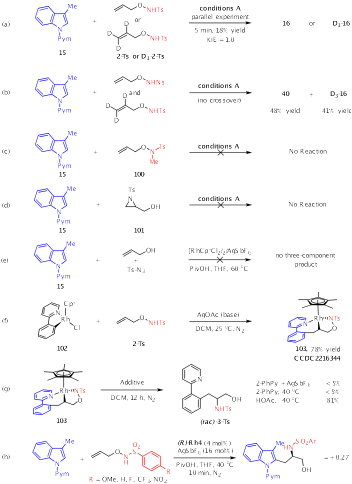
在机理研究方面,将络合物102、2-苯基吡啶和AgOAc的等摩尔混合物在25 ℃下搅拌,可以以较高产率分离出络合物(rac)-103,证明烯烃插入是由螯合配位辅助的。该络合物在AcOH或PivOH存在下可释放出芳氨化的产物(rac)-3-Ts,突出了酸在催化循环中的多重作用。即除了促进C−H键活化外,羧酸还促进了N−O键的断裂,形成氮宾物种,该物种插入Rh−C(烷基)键以构建C−N键。结合一系列对照试验,提出了完整的催化循环。作者认为该偶联可能涉及C−H活化、螯合辅助的烯烃插入、酸辅助氮宾形成、氮宾插入和最终的质子解生成产物(Scheme 5)。而烯烃插入过程是对映和非对映选择性控制步骤。
Scheme 5.Experimental Mechanistic Studies.
综上所述,前沿交叉科学青岛研究院分子科学与工程研究院李兴伟教授团队报道了一种铑催化不对称1,2-碳酰胺化反应合成手性氨基醇的方法。该反应条件温和,适用范围广,具有较高的合成应用价值。上述工作得到山东大学双一流建设经费的资助。
原文链接:https://doi.org/10.1021/jacs.3c01162


